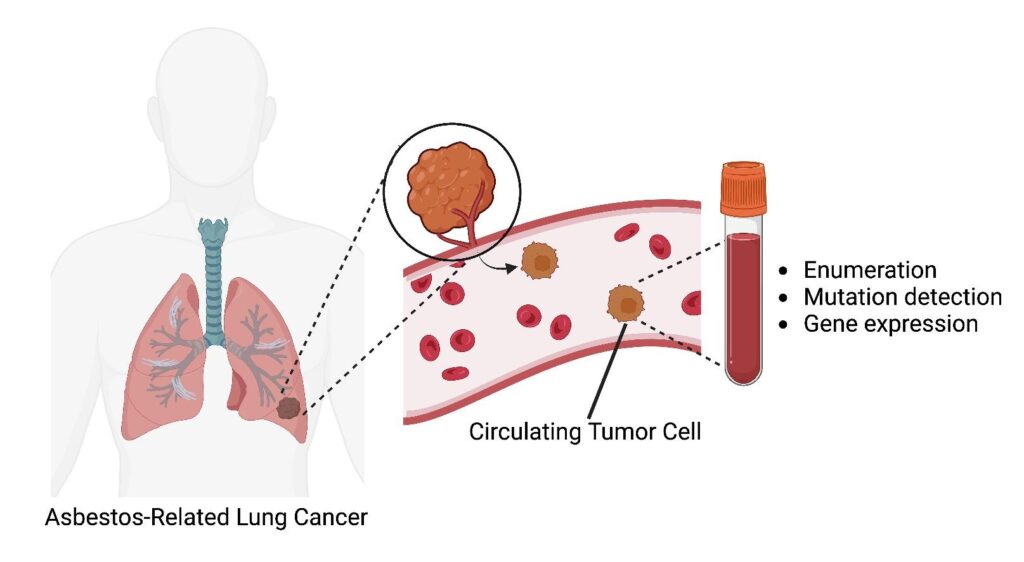
循環腫瘍細胞の検出はアスベスト関連肺がんが疑われる患者に早期診断を提供する可能性がある/Helen Ke et al., Lung Cancer, May 22, 2024●アスベストと関連肺がんアップデート
ハイライト
・ アスベスト関連肺がん(ARLC)の診断は困難である。
・ 循環腫瘍細胞(CTCs)は有望な液体生検バイオマーカーである。
・ CTCsは、アスベストに曝露した人々を含むハイリスク集団のスクリーニングを改善する可能性がある。
・ CTCsは、ARLCに関する分子レベルの洞察を提供し、診断と患者管理を改善する可能性がある。
抄録
アスベスト関連肺がん(ARLC)は、画像診断技術の向上にもかかわらず、現在も診断上の課題となっている。潜伏期間が長いことは、職業・環境に関するデータへのアクセスが限られていること、喫煙や他の発がん物質の複雑な影響と相まって、診断プロセスを複雑にしている。これらの課題をさらに複雑にしているのは、ARLCに特有の病理組織学的または変異的特徴が存在しないことである。PD-L1発現と免疫チェックポイント阻害剤への反応との相関関係はまだ証明されていない。したがって、ARLCの正確な診断を可能にし、予後予測できるようにし、個別化治療を提供するためには、新たなバイオマーカーが必要とされている。循環DNAや循環腫瘍細胞(CTCs)を含むリキッドバイオプシー[液体生検]は、アスベストに曝露した人々を含むハイリスク集団をスクリーニングする、肺がんの新たな診断方法として注目されている。CTCsは計数することができ、分子プロファイリングを行うことで、予測及び予後情報を提供することができる。現在まで、ARLCのリスクがある集団を対象としたCTC研究は実施されていない。ARLCの生物学に関するリアルタイムの分子情報を提供するCTCsの可能性は、ARLC患者の診断と管理を大幅に改善する可能性がある。
1 アスベスト関連肺がん
60か国におけるアスベストの生産と使用を禁止する法律の施行により、前世紀に見られたアスベスト消費量の急激な増加は緩和された。しかし、ロシアとカザフスタンは、依然として何百万トンもの発がん性鉱物であるアスベストを輸出しており、アジアの多くの(発展途上)国ではアスベスト消費量は依然として高いままである。さらに、われわれの環境にアスベスト(製品)が至る所にあるため、改築や解体作業を行う際には、アスベスト繊維を吸い込むリスクが高まる。アスベストへの曝露と肺がん(非小細胞肺がん(NSCLC)及び小細胞肺がん(SCLC)の両方)との関連性は確立されているが、一貫した診断基準の欠如やアスベスト関連肺がん(ARLC)の診断確定の難しさにより、その報告数は過少評価されている可能性が高い。1997年に発表され、2014年に改訂されたアスベスト関連疾患の診断のためのヘルシンキ基準は、患者の歴史がその診断のもっとも重要な要素であるとし、とくに追跡繊維曝露に重点を置いている。しかし、長年にわたる累積(アスベスト繊維)曝露を推定することの難しさや、病理学的(肺)標本における繊維の計数の複雑さから、アスベスト曝露の定量化の難しさが浮き彫りになっている。
慢性的炎症はアスベストの発がんの特徴のひとつであるが、この悪性プロセスのいくつかの段階についてはさらなる解明が必要である。石綿繊維を溶解できないマクロファージの「阻害された貪食」の際に放出されるフリーラジカル種が重要な役割を果たしていると考えられている。現時点では、ARLCと非ARLCを確実に区別する変異シグネチャーは発見されていない。ある研究では、ARLC(扁平上皮)と非ARLCで特異的に発現しているCARD18、MS4A1、ABHD12、API5、ANKRD20A3、LOC402117の6つの遺伝子が特定された。しかし、個々の遺伝子は独立した相関関係を示すには至っていない。別の研究では、ARLCにおいて様々なマイクロRNAがアップレギュレーションまたはダウンレギュレーションされていることが確認されたが、このシグネチャーの予備的検証は実施されていない。特定のゲノム変異は、非ARLCと比較してARLCでより高い頻度で発生しているようであり、KRAS(G>T)におけるトランスバージョン変異、TP53及びp16INK4Aにおける欠失が含まれる。
他の肺がんと比較すると、ARLCでは実行可能な変異の低周波数(EGFR、ALK、NRTK、MET、ALK)が認められた。アスベストに曝露した患者ではHER2変異がわずかに多く、これは最近HER2変異NSCLCに対して承認されたHER2抗体薬物複合体であるトラスツズマブ・デルクステカンによる治療対象となる可能性がある。著者らの知る限り、ARLCにおけるPD-L1発現と免疫療法の結果について記述した報告はこれまで発表されていない。
低線量コンピュータ断層撮影(LDCT)によるスクリーニングは、早期肺がんの発見率を向上させ、死亡率の低下や治癒の可能性を高めるという確立された役割を、ハイリスク集団において担っている。スクリーニングの適応は、年齢と喫煙歴によって定義される。アスベストへの曝露も、とくに喫煙と併発した場合に肺がんリスクを増加させる。アスベストに曝露した集団はLDCTによる肺がんスクリーニングの恩恵を受けていると思われる。アスベストに曝露した集団における早期診断の割合は、「一般」人口と比較しても同程度であることがわかっている。しかし、アスベストに曝露した集団は、スクリーニング試験では過小評価されている。アスベスト曝露は、現在のUSPSTF(アメリカ予防医療専門委員会)の肺がんスクリーニング基準に含まれている。肺がんスクリーニングプログラムにアスベスト曝露者を適切に組み入れることが、液体生検や小細胞肺がんの診断における循環腫瘍細胞(CTC)の評価などの新しい手法の有用性を判断するために必要である。
液体生検では、生物学的体液中に存在するがん関連シグナルの分析も行われる場合がある。このアプローチは、繰り返し採取が可能で、スクリーニングやサーベイランス/治療反応モニタリングへの応用が期待できることから、注目が高まっている。血漿フィブリリン-3や末梢血白血球で測定される8-ヒドロキシ-2′-デオキシグアノシン(8OHdG)などのバイオマーカーは、アスベストに曝露した人々で高値を示すことがわかっている。しかし、これらのバイオマーカーは、ARLCのスクリーニングや発見における有用性を判断するための前向き試験はまだ実施されていない。
循環腫瘍細胞(CTCs)は、循環血液中に放出された腫瘍細胞であり、転移の「種」として機能すると考えられている。CTCは診断の改善につながる可能性があり、また、ハイリスク集団のスクリーニングや予後予測、治療反応性の予測にも使用できる可能性がある。他のいくつかのがん種でも見られるように、肺がんにおいてもCTCの存在は予後不良と相関する。しかし、血液サンプル中のこれらのまれな細胞を迅速かつ正確に検出することは困難であり、CTC検査を日常的な臨床ケアに導入する取り組みは遅れている。CTCを濃縮、分離、同定する技術については、他で詳細に説明されている。概して、その戦略はCTCの物理的特性または特定の腫瘍マーカーの検出に基づいている。これには、フィルター、マイクロ流体デバイス、免疫磁気捕捉法、高解像度画像スキャンなどが含まれる。上皮マーカーであるEpCAMを利用した免疫磁気捕捉法であるCellSearchは、2004年に乳がんに対してFDAの承認を取得し、その後、大腸がん及び前立腺がんに対しても承認された。CellSearchは、肺がんを対象としたCTC検査法としてもっとも研究されているものの、検出率が低い(21~27%)ため、NSCLCにおける日常的な使用は困難である可能性がある。これは、小細胞肺がん(SCLC)では、患者の86%でCTCの分離に成功していることとは対照的である。限られた研究では、胸膜中皮腫患者からCTCを同定している。現時点では、われわれの知る限り、具体的にARLCにおけるCTCを調査した研究はない。
2 アスベスト関連肺がんにおけるCTCの潜在的な役割
アスベストに曝露した集団における肺がんスクリーニングへのCTCの利用は、様々な臨床的状況において有用である可能性がある。CTCはもともと、遠隔転移を伴う(後期)がん事象と考えられていたが、早期がん患者からも検出されており、臨床診断に先立って乳がんや膵臓がん患者からも検出されている。CTCと非血液細胞は、健康な個人、良性腫瘍患者、クローン病などの特定の疾患を持つ患者、及び妊娠中の個人の循環系ではまれにしか検出されない。スクリーニングに必要な高感度と高特異度を実現するには、CTC検出の効率をさらに向上させる必要がある。スクリーニング研究が十分な力を発揮するには、多数の参加者を対象とし、長期間にわたる追跡調査が必要である。幸い、そのような研究は実行可能であることが証明されている。5年間にわたって245人の無症候のハイリスク患者(COPDの元喫煙者)を調査した研究では、日常的なLDCTに加えて、マイクロ流体デバイスであるISET(上皮性腫瘍のサイズによる分離)を用いて5人の患者にCTCが検出された。同じ被験者における年1回のLDCTスクリーニングで検出可能な肺結節が認められ、その後、すべての肺結節がIA期のNSCLCであることが判明した。このスクリーニング研究に参加した他の被験者では、肺結節は発生しなかった。しかし、614人の被験者を対象とした確認のための多施設研究では、感度が26.3%と、上記の研究よりも低く、CTCスクリーニングでは、後に肺がんを発症した19人の被験者を特定できなかったことが報告されている。また、収集したサンプルの2%を分析できなかったことなど、いくつかの技術的な問題も報告されており、プロトコルの改善と標準化の必要性が浮き彫りになっている。興味深いことに、このコホートの4%で肺以外の悪性腫瘍が検出されており、この特殊な集団における他の悪性腫瘍のリスクが強調されている。
CTCは悪性腫瘍の診断を支援するうえで非常に有用である。CTCの重要な利点は、原発組織を特定するのに役立つさらなる分子検査を実施できる機会を提供することである。例えば、CTC上のKRT7及びTTF-1マーカーは肺がん、KRT20/CDX2は大腸がん、PSA/PSMAは前立腺がんに対応している。I期NSCLCの病理診断の確定におけるCTCの役割を評価する研究が進行中である(NCT02380196)。CTCプロファイリングは、ARLC診断の補助となる可能性があるマーカーの検証にも使用できる。
肺がんにおけるCTCの変異プロファイリングも実行可能であると思われる。ARLCの(少数の)割合が標的可能なドライバー変異を保有している可能性があるため、CTCの変異プロファイリングは潜在的な標的療法の特定に役立つ可能性がある。変異プロファイリングに加えて、PD-L1発現を検査することもできる。しかし、前述のとおり、CTCのPD-L1発現に基づいて治療方針を決定することによる臨床転帰に関するさらなる前向き研究が必要である。
CTCは、治療抵抗性の分子学的側面における臨床的に利用可能なリアルタイム情報を提供できる可能性もある。NSCLC患者の70~94%がCTCと原発腫瘍で同じEGFR変異を有していたことから、CTCの分子学的特性は原発腫瘍の特性をほぼ反映している。また、CTCは、異種移植モデルやCTCから分離した細胞株を通じて、ARLCの生物学に関するより深い洞察をもたらす可能性もある。分離したCTCから細胞株を確立することに成功すれば、治療抵抗性のメカニズムに関する洞察も得られる可能性がある。ALK再配列を伴う肺がん患者6人を対象とした研究では、治療に対する抵抗性が生じた時点で採取したCTCに、コピー数の著しい不均一性と染色体不安定性の増大が認められた。治療抵抗性は、ALK陽性上皮性CTCの出現及び/またはALK陽性再構成CTCにおける上皮間葉転換によって生じている可能性があることが示唆された。最後に、CTCのプロファイリングは、小細胞肺がん患者の予後層別化にも使用できる可能性がある。CTCにおける体細胞変異およびコピー数変異の数が少ない患者は、無増悪生存期間及び全生存期間が良好であった。
マクロファージと腫瘍細胞の両方の特性を持つ循環ハイブリッド細胞(CHC)は、ARLCにおけるバイオマーカーとしてCTCの興味深い代替となり得る可能性があるという仮説が立てられている。CHCはARLCではまだ研究されていないが、NSCLC患者では検出されており、調査対象となった5人の患者ではCTCを上回っていた。CHCは新たな研究分野である。CHCは、転移部位においてCTCよりも高い腫瘍形成特性を持つ可能性があり、NSCLC患者の血液中に存在することは、生物学的にもっと攻撃的な疾患であることを示唆し、腫瘍の進行や転移の拡散のリスクが高いことを意味する可能性がある。これらの細胞はしばしば無視され、トロゴサイトーシスや偽陽性とみなされる。
3 結論
ARLCはアスベストへの曝露に起因するものであり、過少報告となっている可能性が高い。ARLCは主として記録されたアスベスト曝露によって定義されるが、放射線学的徴候や肺組織サンプルにおけるアスベスト繊維の存在も診断を裏づける可能性がある。現時点では、ARLCと非ARLCを区別する特定の分子学的特徴は同定されていない。アスベスト曝露者はLDCT肺がん検診から恩恵を受けているようであるが、検診試験では過少評価されている。血液(液体生検)サンプルから検出されるCTCは、アスベストに曝露した人々に対するLDCTスクリーニングに非侵襲的な有益な追加情報を提供し、CTCのプロファイリングを通じてARLCの生物学に関するさらなる洞察をもたらす可能性がある。ARLCにおけるCTC研究はまだ具体的に実施されていないが、CTCはARLC患者の診断、治療、予後の改善につながる可能性を秘めている。
※https://www.lungcancerjournal.info/article/S0169-5002(24)00363-5/fulltext
安全センター情報2024年12月号